Les dépôts réalisés en solution contenant les espèces zinc et manganèse présentent les mêmes caractéristiques que les dépôts de zinc. La morphologie des dépôts est identique à celle de la microphotographie 2. Ainsi la présence de manganèse en solution ne change pas la morphologie du dépôt de zinc.
IV ) 2 Revêtements élaborés en présence d'additifs
L'utilisation d'additifs permet d'obtenir des dépôts, à base de zinc, brillants couvrants, pouvant faire office de revêtements.
Par contre, malgré toutes nos tentatives, nous n'avons pas obtenu de dépôt de manganèse en présence d'additifs.
L'étude cinétique montre que la présence d'additifs, devrait permettre d'obtenir des dépôts contenant à la fois le zinc et le manganèse. Des revêtements de zinc-manganèse vont être ainsi préparés et caractérisés.
IV ) 2.1 Etude en cellule de Hull
L'utilisation de la cellule de Hull permet de définir en quelques essais le comportement d'un bain sur une gamme d'intensité étendue. Elle constitue donc un bon outil pour étudier les deux types d'additifs utilisés durant l'étude cinétique.
Pour chaque bain, on effectue une polarisation galvanostatique en utilisant deux courants d'intensités I=1 A et 2A pendant 5 minutes. Les bains ont la composition suivante :
![]() Bain
B : ZnCl2 ( 75 grl-1
) + MnCl2 (150 grl-1 ) + NH4Cl ( 280 grl-1
)
Bain
B : ZnCl2 ( 75 grl-1
) + MnCl2 (150 grl-1 ) + NH4Cl ( 280 grl-1
)
+ Additif B :
![]() 30 cm3l-1
de Base **
30 cm3l-1
de Base **
![]() 4 cm3l-1 de
brillanteur**
4 cm3l-1 de
brillanteur**
![]() 1 cm3l-1
d'anti mousse.
1 cm3l-1
d'anti mousse.
![]() Bain
A : ZnCl2 ( 75 grl-1
) + MnCl2 (150 grl-1 ) + NH4Cl ( 280 grl-1
)
Bain
A : ZnCl2 ( 75 grl-1
) + MnCl2 (150 grl-1 ) + NH4Cl ( 280 grl-1
)
+ Additif A :
![]() 40 cm3l-1
de Base
40 cm3l-1
de Base
![]() 1 cm3l-1
de brillanteur.
1 cm3l-1
de brillanteur.
** Les concentrations utilisées pour ces dépôts ont été définies avant leur l'étude par voltamétrie cyclique ( cf. § III) 6).
Après la polarisation, les plaques obtenues sont représentées schématiquement en fonction des intensités locales appliquées et de l'aspect du dépôt.
![]() En présence d'Additif B
avec une intensité I =1 A, nous obtenons le résultat suivant:
En présence d'Additif B
avec une intensité I =1 A, nous obtenons le résultat suivant:
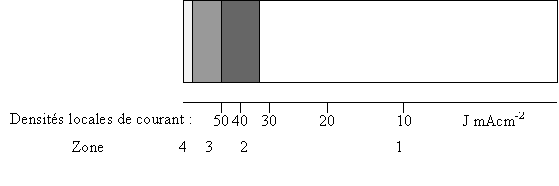
Zone 1: Dépôt brillant gris , uniforme, adhérent
Zone 2: Dépôt brun satiné uniforme, adhérent
Zone 3: Dépôt jaune irrégulier
Zone 4: Dépôt brillant gris non adhérent.
Le bain est pénétrant car on remarque un léger dépôt au verso de la plaque. Les dépôts obtenus avec une intensité de 2 A présentent les mêmes propriétés et confirment ces résultats.
Le bain B permet un dépôt brillant, gris, uniforme pour des densités locales comprises entre 0 et 35 mAcm-2 . Cependant, la qualité du dépôt en zone 2 permet de dire que le dépôt peut supporter des densités de courant jusqu'à 50 mAcm-2.
![]() En présence d'Additif A
avec une intensité I =1 A, nous avons le résultat suivant:
En présence d'Additif A
avec une intensité I =1 A, nous avons le résultat suivant:
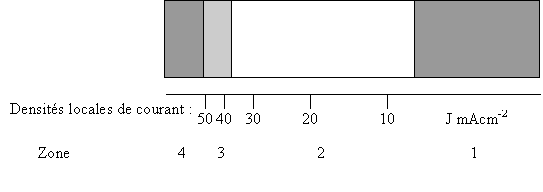
Zone 1 : Dépôt gris mat, non uniforme, adhérent
Zone 2 : Dépôt brun-jaune satiné, uniforme, adhérent
Zone 3 : Dépôt gris non uniforme.
Zone 4 : Dépôt gris mat
Le bain est également pénétrant.
Le bain A permet un dépôt brun-jaune, satiné, uniforme, adhérant pour des intensités locales comprises entre 10 et 40 mAcm-2 . Les dépôts obtenus avec une intensité de 2 A présentent les mêmes propriétés et confirment ces résultats.
Ces résultats permettent de déterminer les limites des densités de courant utilisables pour préparer des dépôts de bonne qualité.
IV ) 2.2 Elaboration des revêtements en cellule de 30 litres
Les conditions d'élaboration et la caractérisation des échantillons présentés dans cette partie sont groupées dans le tableau 1 (page 214)
IV ) 2.2.1 Elaboration de revêtements de référence
Pour évaluer les performances d'un dépôt de zinc-manganèse, il est nécessaire de faire des comparaisons avec des dépôts de référence. Trois types d'échantillons de référence sont considérés.
Le premier type de référence a pour but d'établir des comparaisons en fonction de la présence ou de l'absence de brillanteur dans la solution. Un dépôt de zinc (B8) est élaboré en présence d'additif B avec des concentrations en base et en brillanteur identiques à celles utilisées précédemment pour les essais en cellule de Hull. Le dépôt de zinc B9 est réalisé dans les mêmes conditions en absence de brillanteur.
Le second type de référence est constitué par des dépôts de zinc pur élaborés à partir de bains industriels utilisés actuellement. Le premier bain est un bain de zinc en milieu acide avec de l'additif A aux concentrations préconisées par le formulateur (dépôt A5). Le second est un bain de zinc en milieu alcalin à base d'additif O (dépôt O1).
L'échantillon O2 n'est pas élaboré par nos soins; il constitue un troisième type de référence.
|
Nom |
Bain |
Additif |
[Base] ml l-1 |
[Brillant.]ml l-1 |
j mA cm-2 |
Epaisseur m m |
|
B8 |
Zinc acide |
B |
30 |
4 |
20 |
9 |
|
B9 |
Zinc acide |
B |
30 |
0 |
20 |
10 |
|
A5 |
Zinc acide |
A |
20 |
3 |
20 |
10 |
|
O1 |
Zinc alcalin |
O |
* |
* |
20 |
10 |
|
O2 |
Zinc alcalin |
* |
* |
* |
* |
10 |
La valeur de l'épaisseur des dépôts présentée dans le tableau est en fait la moyenne des mesures en divers points de l'échantillon. Cette mesure moyenne n'est pas totalement représentative de l'épaisseur réelle du revêtement car la répartition du dépôt est plus ou moins uniforme en fonction des paramètres d'élaboration. La comparaison des profils en trois dimensions, basée sur des mesures ponctuelles, de revêtements élaborés en milieu acide et en milieu alcalin illustre cet aspect. La figure 39 présente le profil caractéristique de ces deux types de revêtements. Nous observons une répartition uniforme du dépôt de zinc alcalin (O1) sur la surface du substrat et une concavité du dépôt de zinc acide (A5). Les mesures ponctuelles réalisées lors de cette étude montrent que le profil du revêtement A5 est représentatif de la répartition relative des épaisseurs de tous les revêtements réalisés en milieux acides. Les dépôts seront caractérisés par la moyenne des mesures tout en tenant compte du caractère relatif de cette grandeur. La répartition non uniforme du zinc en milieu acide constitue l'inconvénient majeur de ce type de bain. En effet, une mauvaise répartition du dépôt de zinc augmente le risque d'obtenir des surfaces non revêtues, notamment pour des pièces à géométrie particulière ou pour des dépôts fins. Par contre, la bonne répartition du zinc alcalin permet d'envisager l'utilisation de revêtement en bicouche alliant une bonne répartition du dépôt de zinc alcalin et les propriétés du dépôt zinc-manganèse pour la couche extérieure.
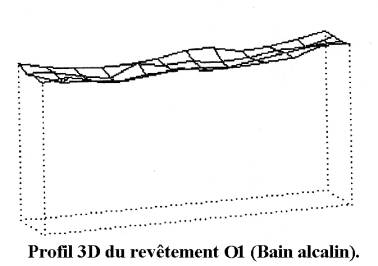
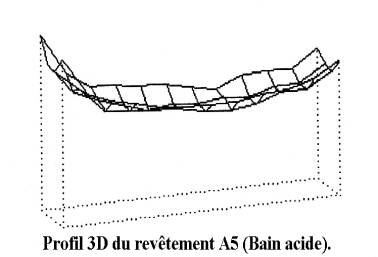
Figure 39 : Profils 3D de différents revêtements obtenus en milieu alcalin et acide.
IV ) 2.2.2 Elaboration de revêtements zinc-manganèse
Pour chaque bain, les dépôts sont élaborés avec trois densités de courant (10, 20, 30 mAcm-2). Ces courants sont fixés d'une part par la valeur minimale supposée suffisante pour obtenir la surtension nécessaire à la réduction des espèces manganèse, et d'autre part par l'intensité maximale fournie par le redresseur. Les durées d'élaboration des dépôts sont déterminées afin d'obtenir une épaisseur du revêtement de 10 mm tout en tenant compte des rendements. Les conditions nécessaires à l'obtention de cette valeur nominale n'étant pas encore parfaitement connues, les épaisseurs des dépôts s'écartent de la valeur théorique de 10 mm. Les dépôts obtenus lors de cette série sont nommés de B1, B2, B3 pour des revêtements élaborés en présence de B et A2, A3, A4 pour des revêtements élaborés en présence de A. Les résultats des dosages en manganèse et des mesures d'épaisseur sont présentés dans le tableau suivant:
|
Nom |
Additif |
J mAcm-2 |
t mn |
e mm |
% Mn |
|
B1 |
B |
10 |
60 |
13 |
0,5 |
|
B2 |
B |
20 |
30 |
9,5 |
2,5 |
|
B3 |
B |
28,5 |
16 |
8,5 |
4 |
|
A2 |
A |
10 |
60 |
13 |
0 |
|
A3 |
A |
20 |
30 |
10,5 |
0 |
|
A4 |
A |
28,5 |
16 |
8,5 |
0 |
Les dépôts obtenus en présence d'additif A, ne contiennent pas de manganèse. En présence de B le pourcentage de manganèse est relativement faible ( inférieur ou égal à 4%). Or, la teneur en manganèse des échantillons étalons ( cf. § II) 3.4) élaborés précédemment est plus élevée. Cet effet peut s'expliquer par la présence d'anode en zinc. En effet, l'introduction d'anode en zinc implique l'enrichissement du bain en zinc par rapport au manganèse, chaque espèce manganèse réduite à la cathode étant remplacée par une espèce zinc oxydée à l'anode. De plus nous pouvons supposer que l'introduction d'additif modifie d'une façon dissymétrique la réaction d'oxydation et la réaction de réduction (diminution du rendement). L'équilibre entre les espèces zinc qui se réduisent à la cathode durant le dépôt et celles qui sont oxydées à l'anode est rompu. On pourrait envisager une
compensation de cet effet par l'ajout régulier de chlorure de manganèse pour garder le même rapport de concentration entre les espèces zinc et les espèces manganèse.
L'utilisation d'additif B est nécessaire pour obtenir un pourcentage de manganèse significatif dans le dépôt. Cependant le taux de manganèse contenu dans le revêtement reste faible, et des essais sont effectués en modifiant les conditions expérimentales pour essayer d'augmenter la teneur en manganèse.
![]() Le premier changement concerne
le dispositif expérimental. En utilisant la cellule compartimentée (meilleur
contrôle des paramètres électrochimiques), le dépôt A1 (en présence de
l'additif A, en conservant les mêmes concentrations en base et brillanteur)
obtenu a une épaisseur moyenne de 9 mm et contient 5 % de manganèse.
Le premier changement concerne
le dispositif expérimental. En utilisant la cellule compartimentée (meilleur
contrôle des paramètres électrochimiques), le dépôt A1 (en présence de
l'additif A, en conservant les mêmes concentrations en base et brillanteur)
obtenu a une épaisseur moyenne de 9 mm et contient 5 % de manganèse.
![]() Le second changement
concerne la concentration des composants de l'additif B. Nous choisissons
d'utiliser les concentrations en additif B déterminées lors de la partie
consacrée à l'étude cinétique ( cf. § III) 6 ). Les concentrations en base et
brillanteur B prennent les valeurs respectives de 35 et 6,5 ml l-1.
Pour augmenter la probabilité d'obtenir du manganèse , les dépôts sont préparés
sous des intensités de courant de 40, 50 ,60 mAcm-2. Une série de quatre
dépôts ( B4, B5, B6, B7) est ainsi obtenue avec des taux de manganèse
supérieurs à 12%. Le tableau suivant présente les caractéristiques des nouveaux
dépôts de zinc-manganèse.
Le second changement
concerne la concentration des composants de l'additif B. Nous choisissons
d'utiliser les concentrations en additif B déterminées lors de la partie
consacrée à l'étude cinétique ( cf. § III) 6 ). Les concentrations en base et
brillanteur B prennent les valeurs respectives de 35 et 6,5 ml l-1.
Pour augmenter la probabilité d'obtenir du manganèse , les dépôts sont préparés
sous des intensités de courant de 40, 50 ,60 mAcm-2. Une série de quatre
dépôts ( B4, B5, B6, B7) est ainsi obtenue avec des taux de manganèse
supérieurs à 12%. Le tableau suivant présente les caractéristiques des nouveaux
dépôts de zinc-manganèse.
|
Nom |
Présence de Mn |
Type d'Additif |
[Base] ml l-1 |
[Brillant.] ml l-1 |
J mA cm-2 |
e mm |
% Mn |
|
A1 |
Oui |
A |
40 |
1 |
20 |
9 |
5 |
|
B4 |
Oui |
B |
35 |
6,5 |
20 |
7 |
13 |
|
B5 |
Oui |
B |
35 |
6,5 |
40 |
7 |
15 |
|
B6 |
Oui |
B |
35 |
6,5 |
50 |
6,5 |
15 |
|
B7 |
Oui |
B |
35 |
6,5 |
60 |
7 |
14 |
Ces dépôts très variés sont caractérisés par diverses méthodes: microscopie électronique à balayage, diffraction de rayons X, test de corrosion par polarisation et impédance électrochimique.
IV ) 3 Morphologie de la surface des dépôts et revêtements
L'examen au microscope électronique à balayage des dépôts réalisés en présence d'additif ne permet pas de distinguer les cristallites étant donné leur finesse. Cette observation montre que l'additif change de manière radicale la morphologie du dépôt. Pour obtenir une image de la surface du dépôt nous utilisons une autre technique: la microscopie à force atomique.
La figure 40 présente la topographie de la surface obtenue par microscopie à force atomique de l'échantillon B3. La taille des cristallites est de l'ordre de 0,3 mm et la rugosité du dépôt de l'ordre de 0,5 mm. Le dépôt obtenu est compact. La taille, la géométrie, la disposition de ces cristallites ne présentent aucun caractère commun avec celles des dépôts obtenus sans additif. La disparition des espaces existants entre les empilements et la finesse du dépôt permet de penser que la présence d'additif améliore la tenue en corrosion des revêtements.

Figure
40 (1): Topographie du revêtement B3 élaboré en
présence d'additif.
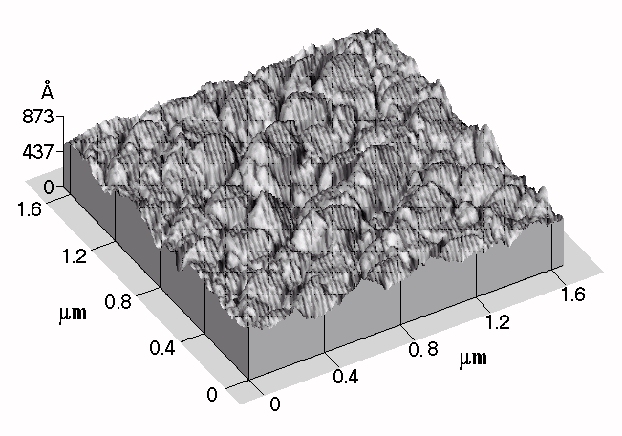
Figure 40 (2) : Topographie du revêtement B3 élaboré en présence d'additif.
IV ) 4 Etude de la structure cristalline
Une diffraction de rayons X est effectuée sur chaque échantillon en mode couplé q-2q afin de déterminer la nature des phases cristallines qui composent le revêtement.
IV ) 4.1 Identification des phases MnyZnx par diffraction de rayons X
La synthèse des alliages MnyZnx peut conduire à la formation de composés monophasés ou polyphasés. La diffraction de rayons X permet de caractériser chaque échantillon en établissant un diagramme de diffraction. En fonction du diagramme de diffraction obtenu, nous pouvons nous trouver dans deux situations différentes :
Première situation: le diagramme de diffraction correspond à une fiche d'un composé répertorié dans la base JCPDS. L'identification des phases peut alors se faire. Par exemple, l'existence des fiches JCPDS des corps purs à base de zinc et de manganèse permettent d'identifier la présence de ces phases dans les revêtements.
Deuxième situation: Le fichier JCPDS ne contient pas les fiches correspondantes aux phases formées. C'est le cas les phases MnyZnx dont les fiches sont absentes, à ce jour, de la base JCPDS. Il faut donc trouver une méthode indirecte afin d'identifier et caractériser ces phases. La proximité du comportement physico-chimique du manganèse et du fer ainsi qu'une revue bibliographique nous permettent d'établir des relations entre deux types de phases.
![]() Relation
d'isostructuralité entre la phase d1 -MnZn9 et la phase d-Fe-Zn.
Relation
d'isostructuralité entre la phase d1 -MnZn9 et la phase d-Fe-Zn.
Dans une étude consacrée à la phase d1 -MnZn9, une relation d'isostructuralité est établie entre cette phase et la phase correspondante du système d-Fe-Zn [51 et ses références]. Cette phase non stœchiométrique peut contenir de 86 à 92% atomique de zinc. La maille est hexagonale et comprend 550 ± 8 atomes. L'isostructuralité entre ces deux phases est vérifiée par une autre étude qui montre une correspondance entre le diagramme de diffraction d'une phase d1 d'un alliage de zinc-manganèse réalisé en fonderie (12 % at. de Mn) et la fiche JCPDS de la phase FeZn7 [52]. Le résultat de cette étude est présenté sur la figure 41. Le décalage observé entre les pics et la fiche JCPDS relative à la phase FeZn7 résulte de la différence de paramètres de mailles entre le fer et le manganèse.
Ainsi, les fiches JCPDS des composés d-Fe-Zn, vont être utilisées pour identifier des phases de d zinc-manganèse .
![]() Relation
d'isostructuralité entre la phase z -MnZn13
et la phase z -Fe-Zn.
Relation
d'isostructuralité entre la phase z -MnZn13
et la phase z -Fe-Zn.
Le même type de relation existe entre la phase z -MnZn13, monoclinique qui comprend 28 atomes par maille, et la phase correspondante de z-Fe-Zn.
IV ) 4.2 Etude d'un dépôt de manganèse
La première étude en diffraction de rayons X porte sur un dépôt de manganèse pur élaboré dans un bain sans additif (MnCl2 (0,5M) + NH4Cl (5M)) en appliquant une intensité de 30 mAcm-2 pendant 1000 secondes. Le diagramme de diffraction 42a (figure 42), effectué deux jours après la synthèse, présente deux séries de pics :
![]() La première série de
pics aux angles 2q = 45°, 65° correspond à la fiche JCPDS n°6-0696 du fer constituant le substrat d'acier. L'intensité
relative de ces pics montre un recouvrement relativement bon de la surface par
le dépôt.
La première série de
pics aux angles 2q = 45°, 65° correspond à la fiche JCPDS n°6-0696 du fer constituant le substrat d'acier. L'intensité
relative de ces pics montre un recouvrement relativement bon de la surface par
le dépôt.
Figures 41 et 42
![]() La deuxième série de
pics aux angles 2q = 42°, 51°, 73°, 86° correspond à la fiche JCPDS n° 17-0910 de la
phase g du
manganèse (variété haute température) qui cristallise en mode tétragonal avec
les paramètres a=2,672; c=3,550 ( cf. § I) 2.1 ).
La deuxième série de
pics aux angles 2q = 42°, 51°, 73°, 86° correspond à la fiche JCPDS n° 17-0910 de la
phase g du
manganèse (variété haute température) qui cristallise en mode tétragonal avec
les paramètres a=2,672; c=3,550 ( cf. § I) 2.1 ).
Pour vérifier le caractère métastable de cette phase, un second diagramme de diffraction 42b a été effectué deux ans après. Le nouveau diagramme de diffraction présente la même série de pics correspondant au substrat d'acier ainsi qu'une série de pics correspondant à la fiche JCPDS n° 32-637 de la phase a du manganèse (variété basse température). La succession de ces deux diagrammes de diffraction met en évidence la transformation allotropique entre la phase g et la phase a.
IV ) 4.3 Etude des revêtements de zinc-manganèse
La figure 43 présente le diagramme de diffraction du revêtement B1 (0,5% Mn). En fait ce diagramme de diffraction est représentatif des analyses faîtes sur les échantillons de zinc pur. Comme le révèle le diagramme de diffraction ce taux de manganèse est trop faible pour constituer une phase visible ou pour modifier une phase cristalline existante. Ce diagramme de diffraction présente une série de pics qui peut être facilement identifiée par la superposition de la fiche JCPDS n°4-0831 du zinc, et une autre série de pics, d'intensité très faible, aux angles 44,8°, 65°, 82°. Cette dernière série de pics, qui correspond à la fiche 6-0696 du fer, caractérise le substrat d'acier. Nous pouvons noter un phénomène d'extinction de certains pics du zinc aux angles 36°, 54,5° qui correspondent aux plans cristallins (002), (102) ainsi qu'une différence d'intensité relative des pics par rapport à la fiche JCPDS. Cet aspect peut être expliquer par le mode spécifique de préparation du dépôt en présence d'additif. La comparaison des différents diagrammes de diffraction des revêtements de zinc montre en effet une variation des intensités relatives en fonction des conditions d'élaborations et plus particulièrement en fonction des additifs utilisés.
La figure 44 présente le diagramme de diffraction obtenu sur le revêtement B2 (2,5% Mn). Il est constitué de deux séries de pics qui correspondent au zinc et au fer. Une troisième série de pics constitue un massif entre les angles 41° et 45° qui correspond à la fiche JCPS n°45-1184 du FeZn10,98. Ce revêtement comporte deux phases, une phase de zinc largement majoritaire et une phase de d zinc-manganèse. Le diagramme de diffraction ne présente pas
Figure 43 et 44
Figures 45 et 46
de pic correspondant à la phase manganèse, la totalité du manganèse est donc contenu dans des phases zinc-manganèse.
Pour des taux de manganèse inférieurs ou égal à 6% (y compris en utilisant de l'additif A), on obtient le même type de diagramme de diffraction (figure 45) avec des intensités relatives différentes. Quand la teneur en manganèse augmente, l'intensité des pics due à la présence de la phase zinc-manganèse devient plus significative par rapport à celle des pics attribués à l'existence de la phase de zinc. On ne détecte pas de manganèse pur.
Quand le taux de manganèse dépasse 12% le diagramme de diffraction reste du même type (figure 46, revêtement B6, 15% Mn). Cependant une nouvelle série de pics apparaît qui correspond à la fiche n°32-0637 du manganèse a. Les conditions électrochimiques d'élaboration, qui permettent la cristallisation d'un pourcentage élevé de manganèse, conduisent à la cristallisation individuelle de ce dernier élément. Il semble que la partie du manganèse qui cristallise séparément correspond à un excès qui ne parvient pas à s'intégrer dans une phase avec le zinc. Cette hypothèse peut être confirmée par l'observation des intensités relatives de chaque série de pics. Les phases de zinc et les phases de manganèse présentent des intensités relatives très faibles par rapport à l'intensité de la phase de zinc-manganèse. Ainsi, le zinc et le manganèse cristallisent majoritairement sous la forme de phase zinc-manganèse. L'importance relative des pics liés au substrat est simplement corrélée à l'épaisseur du dépôt.
IV ) 5 Etude du comportement en corrosion des revêtements par polarisation potentiodynamique
Le tracé de la courbe courant/tension permet souvent d'obtenir une vue d'ensemble du processus de corrosion d'une électrode dans un milieu donné. En imposant un balayage en potentiel et en mesurant simultanément l'intensité du courant qui résulte des réactions anodiques et cathodiques, on obtient une courbe qui donne une image des différents processus électrochimiques produits par le potentiel imposé. Les courbes potentiodynamiques sont habituellement tracées à partir du potentiel stable en immersion libre vers les potentiels cathodiques, puis vers les potentiels anodiques. En suivant ce protocole, les tracés obtenus pour les dépôts de zinc et les dépôts de zinc-manganèse sont similaires. Ce type d'essais électrochimique tels que nous les avons appliqués ne nous donne aucun renseignement sur le comportement à la corrosion des dépôts.
Pour essayer d'obtenir une caractérisation des échantillons, la polarisation est appliquée à partir d'une valeur de potentiel cathodique par rapport à -300 mV par rapport au potentiel de repos vers les potentiels anodiques, dans une solution NaCl 0,5M avec une vitesse de balayage fixée à 0,5 mVs-1.
IV ) 5.1 Revêtements de zinc
Le tableau suivant présente les conditions d'élaboration des différents échantillons de zinc dont les courbes de polarisation sont présentées dans la figure 47.
|
|
Composition du bain |
|
|
|
|||
|
Nom |
Présence de Mn |
Additif |
[Base] mll-1 |
[Brillant.] mll-1 |
J mA cm 2 |
e mm |
% Mn |
|
B8 |
Non |
B |
30 |
4 |
20 |
9 |
0 |
|
B9 |
Non |
B |
30 |
0 |
20 |
10 |
0 |
|
A2 |
Oui |
A |
40 |
1 |
10 |
13 |
0 |
|
A5 |
Non |
A |
20 |
3 |
20 |
10 |
0 |
|
O1 |
Non |
O |
* |
* |
20 |
10 |
0 |
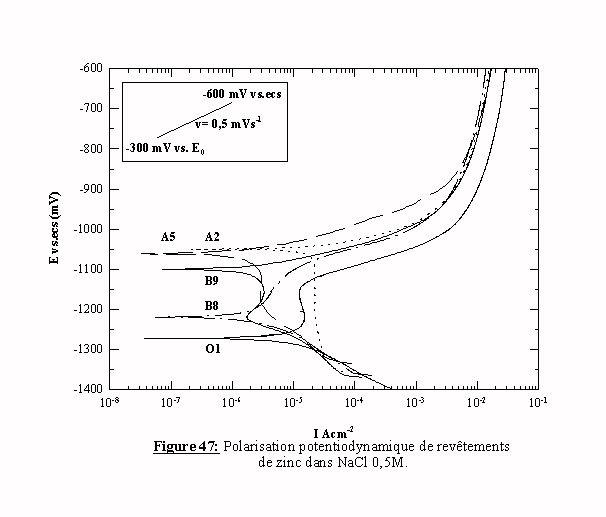
Les tracés obtenus présentent une allure particulière. En effet, on observe pour chaque tracé une inflexion puis un pic (ou inversement) avec une variation du potentiel à courant nul E(i=0) dans une gamme de potentiel allant de –1370 mV/ecs à –1050 mV/ecs en fonction des conditions de préparation. La particularité de ces tracés peut être expliquée par l'intervention de réactions de destruction et/ou de formation d'oxydes en fonction des potentiels appliqués.
Les échantillons B8 et B9 présentent des tracés très différents avec des potentiels à courant nul de -1220 et –1100 mV/ecs. Les deux échantillons diffèrent uniquement par la présence du brillanteur dans le bain, et l'on sait que le brillanteur modifie considérablement la morphologie du dépôt (taille des grains, orientation cristallographique). Il est maintenant admis que la morphologie d'un dépôt est un facteur qui conditionne le comportement à la corrosion. Ceci permet d'expliquer la différence de comportement à la corrosion de dépôts de zinc de nature chimique identique mais de morphologie différente [53]. Cette différence de comportement à la corrosion en fonction de la morphologie de l'électrode a aussi été mise en évidence par la comparaison de deux aciers de même composition, l'un préparé par la métallurgie habituelle, l'autre par le frittage [54].
Pour établir une relation entre ce facteur et les tracés obtenus, il faut d'une part déduire la valeur des paramètres électrochimiques qui caractérise un comportement en corrosion ( icorr, ba, bc ...), ce qui n'est pas possible. D'autre part, il faudrait faire une étude complète de la morphologie du dépôt ( rugosité, mesure d'aire réelle, étude cristallographique...). Cette étude déborde du cadre de cette thèse, nous allons donc simplement comparer les résultats obtenus avec les revêtements de zinc avec ceux des revêtements de zinc-manganèse.
IV ) 5.2 Revêtement de zinc-manganèse
La figure 48 présente les résultats des polarisations effectuées sur les revêtements B3, B7, A1 contenant respectivement 4, 14 et 5 % de manganèse.
|
|
Composition du bain |
|
|
|
||||||
|
Nom |
Présence de Mn |
Additif |
[Base] mll-1 |
[Brillant.] mll-1 |
J mA cm 2 |
e mm |
% Mn |
|||
|
B3 |
Oui |
B |
30 |
4 |
30 |
8,5 |
4 |
|||
|
B7 |
Oui |
B |
35 |
6,5 |
60 |
7 |
14 |
|||
|
A1 |
Oui |
A |
40 |
1 |
20 |
9 |
5 |
|||
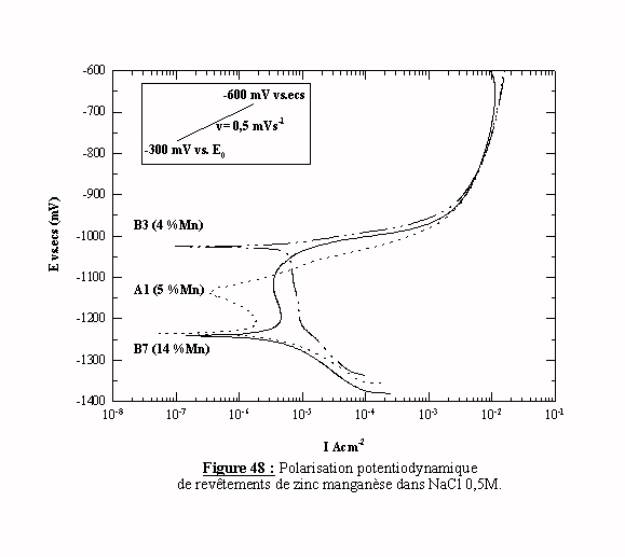
Chaque échantillon est représentatif des revêtements élaborés dans la même série. Les tracés obtenus ont la même allure générale que ceux des échantillons de zinc, nous sommes confrontés au même problème que précédemment pour caractériser les échantillons par cette méthode, car le manganèse n'induit pas de changements fondamentaux dans l'allure des tracés.
De plus, la relation entre le pourcentage de manganèse, la concentration de base et de brillanteur et l'état de surface du dépôt, ne permet pas de conclure sur l'effet éventuel du manganèse sur les tracés potentiodynamiques.
Dans notre cas, la technique de polarisation potentiodynamique ne permet pas de caractériser le comportement à la corrosion des revêtements.
IV ) 6 Etude du comportement en corrosion des revêtements par mesure d'impédance électrochimique
IV ) 6.1 Introduction
Ce chapitre est consacré à la caractérisation des différents revêtements, en situation de corrosion, en utilisant la technique de mesure d'impédance électrochimique. Cette technique permet d'évaluer, in situ, les paramètres qui caractérisent l'interface électrode\électrolyte en imposant une perturbation de 2 mV autour du potentiel corrosion. La valeur de l'amplitude de la perturbation est choisie afin de ne pas perturber le processus de corrosion pendant la mesure d'impédance. La corrosion est la conséquence d'un processus électrochimique résultant du transfert de charges entre l'électrolyte et la surface du métal. En effet, cette interface est le siège de deux types de réactions simultanées: une réaction de réduction des espèces en solution et une réaction d'oxydation du métal. C'est cette dernière réaction qui provoque la détérioration de l'électrode immergée. Nous distinguons généralement trois processus de corrosion: (a) un processus de dissolution sans intervention des produits de corrosion, (b) un processus de dissolution avec formation de couche de produits de corrosion, (c) un processus de dissolution à travers un film compact formé. Ces trois processus peuvent être résumés par les schémas suivants:

IV ) 6.2 Instabilité du système
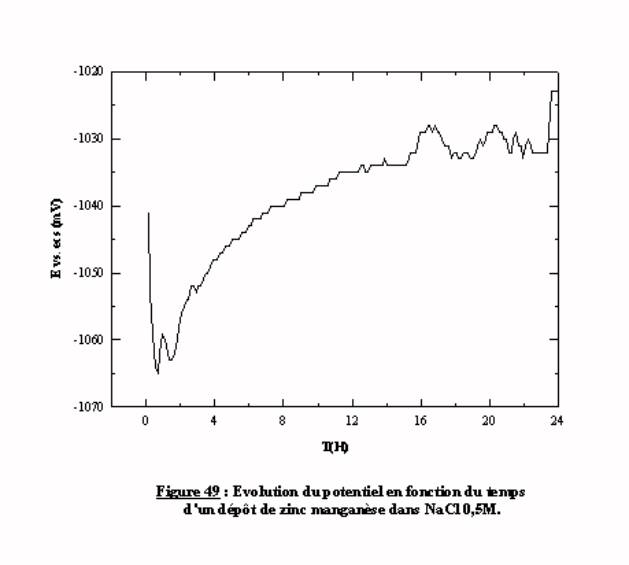
La complexité du processus de corrosion peut être mise simplement en évidence par la mesure du potentiel d'électrode. Un suivi de l'évolution du potentiel d'un échantillon, en fonction du temps d'immersion, reflète les changements qui peuvent se produire sur l'électrode (formation, détachement de produits de corrosion...). La figure 49 présente l'évolution du potentiel d'un dépôt de zinc-manganèse sur un substrat d'acier, immergé dans du chlorure de sodium, pendant 24 heures. La variation du potentiel indique que l'évolution du système au cours du temps est permanente et met en évidence le caractère instable de ce système. Un suivi du potentiel en fonction du temps donne une première indication sur le comportement des revêtements en situation de corrosion.
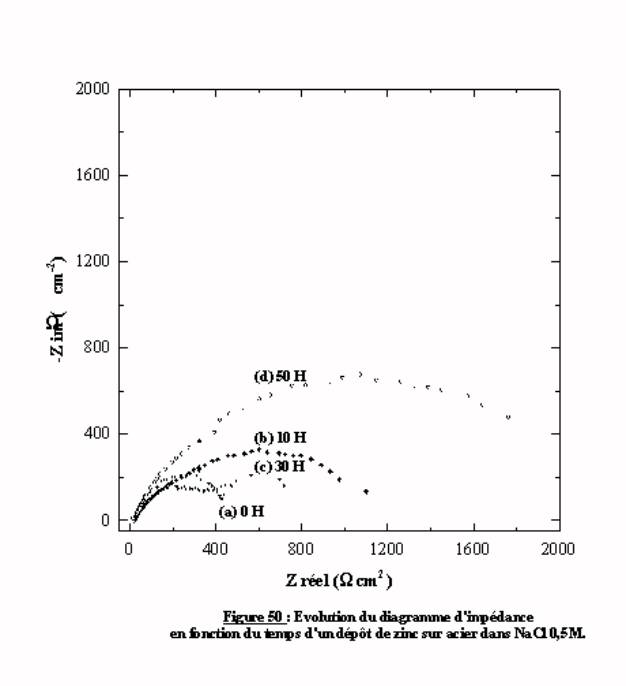
Le suivi du comportement en corrosion en fonction du temps peut être effectué par une mesure d'impédance électrochimique. La figure 50 présente l'évolution des diagrammes d'impédance d'un même échantillon pour des durées d'immersion différentes. Les quatre diagrammes présentent de grandes différences. Le diagramme (a) présente deux boucles capacitives contrairement au diagramme (b) qui présente une boucle capacitive unique aplatie de diamètre supérieur. Le diagramme (c) obtenu après 30 heures d'immersion est comparable au diagramme (a). Après 50 heures d'immersion (d), on retrouve une boucle capacitive unique de grand diamètre. La succession de ces diagrammes d'impédance, sans logique apparente, reflète le caractère complexe de l'évolution de la nature de l'interface de l'électrode en situation de corrosion. Chaque mesure reflète l'état de l'interface de l'échantillon à un moment donné.
IV ) 6.2.1 Diagramme d'impédance
Malgré la complexité du comportement du dépôt en corrosion, un diagramme d'impédance peut être obtenu de façon reproductible en fixant la durée d'immersion à 1 heure. Dans ces conditions, les diagrammes d'impédance relatifs aux différents dépôts peuvent être comparés.
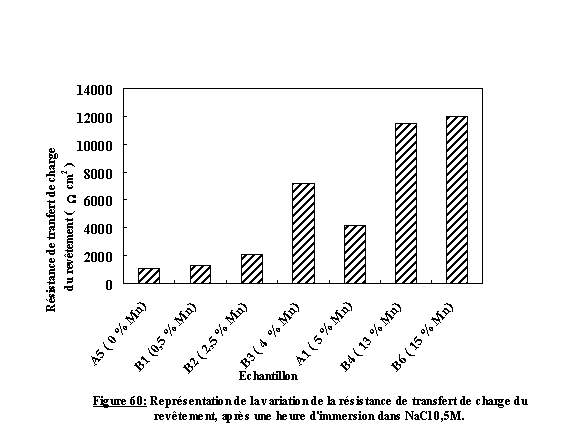
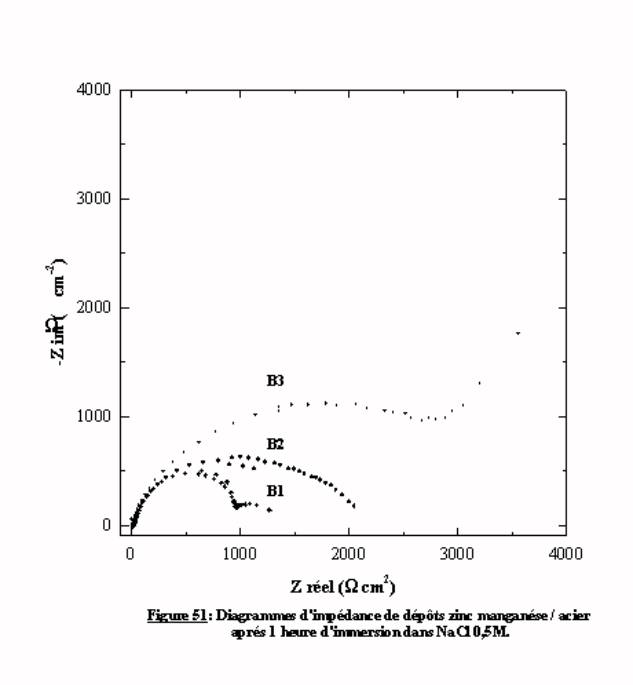
La figure 51 présente les trois diagrammes d'impédance des échantillons B1, B2, B3 dont les caractéristiques ont été présentées dans le chapitre IV ) 2.2.2 . En fonction des paramètres d'élaboration, on note une évolution de l'allure et de la taille des diagrammes. Il reste à mettre en place une méthode permettant la comparaison des résultats.
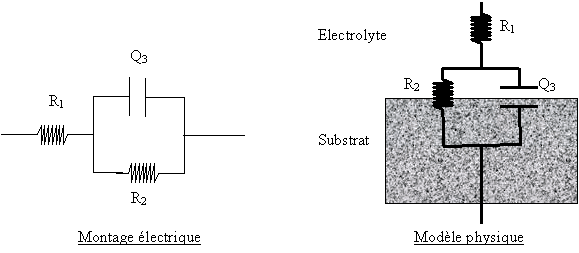
En assimilant le diagramme à une simple boucle capacitive et en considérant un circuit équivalent simple du type R(RQ), on peut estimer les grandeurs électriques des différents composants du circuit.
I) Circuit équivalent simple.
Ce modèle s'applique aux cas de corrosion mettant en jeu un processus de dissolution direct sans intervention des produits de corrosion. Le circuit électrique est composé des 3 éléments dont la signification est :
R1 : Résistance non compensée,
R2 : Résistance de transfert,
Q3 : Capacité de double couche.
Les figures suivantes présentent le montage électrique et le modèle physique:
Le codage du circuit pour le logiciel EQUIVCRT est : R1(R2Q3).
La simulation mathématique sur ce type de circuit donne un diagramme présentant une boucle capacitive.
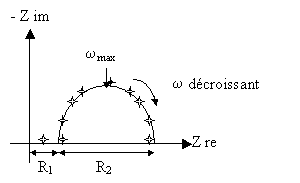
Les valeurs des composantes électriques peuvent être estimées en se référant à des points remarquables du diagramme. R1 et R2 sont évalués directement par une lecture sur l'axe des réels, la valeur de la capacité pouvant être calculée à partir du point où la contribution capacitive est maximale par la formule :
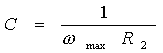
La précision des mesures obtenue par cette méthode est très faible, dans le meilleur des cas on obtient un ordre de grandeur de chaque composante du circuit. De plus, l'allure des diagrammes expérimentaux nous indique que les systèmes sont en fait plus complexes que le modèle proposé. En effet B1 et B3, présentent deux boucles capacitives. Il faut donc tenir compte de la présence d'une seconde constante de temps en introduisant dans le circuit équivalent une seconde capacité. Nous pouvons envisager deux types de circuits équivalents à deux constantes de temps.
II) Circuit équivalent à deux constantes de
temps type Randles
Ce type de circuit est utilisé dans de nombreuses publications pour caractériser des systèmes plus complexes. Il peut être utilisé pour caractériser le comportement d'un revêtement sur un substrat en introduisant le concept de pores et de produits de corrosion. Ce modèle comporte les éléments électriques suivants :
R1 : Résistance non compensée,
Q2 : Capacité de double couche du revêtement,
R3 : Résistance dans les pores,
Q4 , R5 étant représentatifs de la contribution des produits de corrosion.
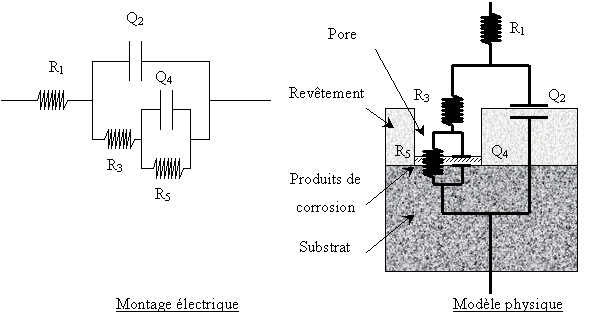
Le montage électrique et le modèle physique correspondant sont les suivants:
Le codage pour le logiciel EQUIVCRT est R1(Q2(R3(Q4R5))).
Cependant, ce modèle ne convient pas pour
ajuster les diagrammes d'impédance obtenus expérimentalement. En effet, les
simulations mathématiques produites à partir de ce modèle physique ne sont pas
en accord avec nos résultats expérimentaux. Il faut donc élaborer un autre
modèle en suivant la méthode décrite par l'organigramme de caractérisation des
interfaces ( cf. § II) 2.4 ).
III) Circuit équivalent utilisé
Après un nombre conséquent de recherches infructueuses, nous avons mis au point un circuit équivalent, correspondant à un modèle physique cohérent dont la simulation mathématique est en accord avec nos résultats expérimentaux. Ce modèle est constitué par les éléments électriques suivants:
R1 : Résistance non compensée,
R2 : Résistance de transfert de charge du revêtement,
Q3 : Capacité de double couche du revêtement,
R4 , Q5 étant représentatifs de la contribution des produits de corrosion.
Le montage électrique et le modèle physique correspondant sont les suivants:
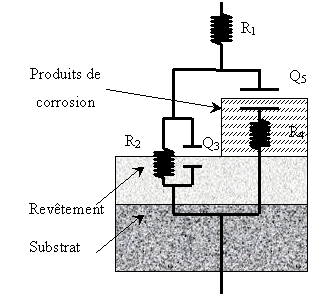
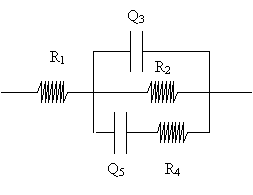
Le codage est le suivant: R1(R2Q3(R4Q5))
En utilisant ce modèle, on détermine les grandeurs électriques de chaque échantillon. Les figures suivantes présentent les résultats expérimentaux les plus significatifs ainsi que les résultats des simulations mathématiques.
La totalité des résultats est présentée sous la forme de tableau. La partie gauche du tableau rappelle les conditions d'élaboration et les caractéristiques des échantillons. Les valeurs numériques des éléments du circuit équivalent présentant la meilleure corrélation entre la simulation mathématique et les données expérimentales, sont placées dans la partie droite.
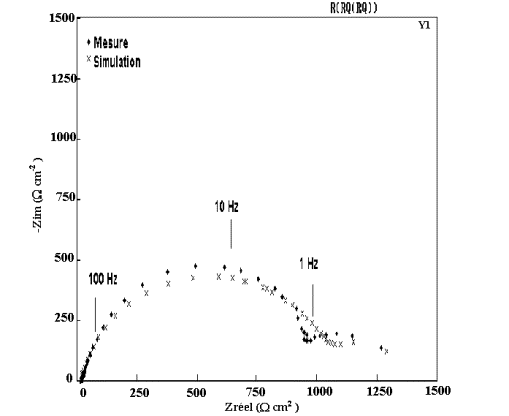
Figure 52: Modélisation et diagramme expérimental d'impédance
du dépôt B1 ( 0,5% de Mn) après 1 heure d'immersion dans NaCl 0,5M.
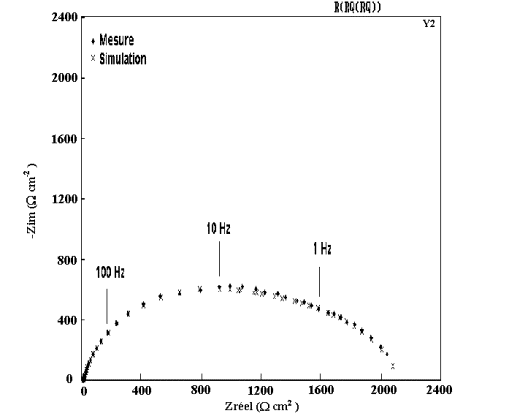
Figure 53: Modélisation et diagramme expérimental d'impédance
du dépôt B2 ( 2,5% Mn) après 1 heure d'immersion dans NaCl 0,5M.
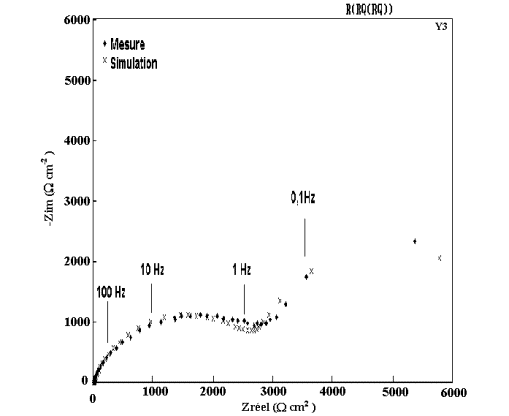
Figure 54: Modélisation et diagramme expérimental d'impédance
du dépôt B3 ( 4 % Mn) après 1 heure d'immersion dans NaCl 0,5M.
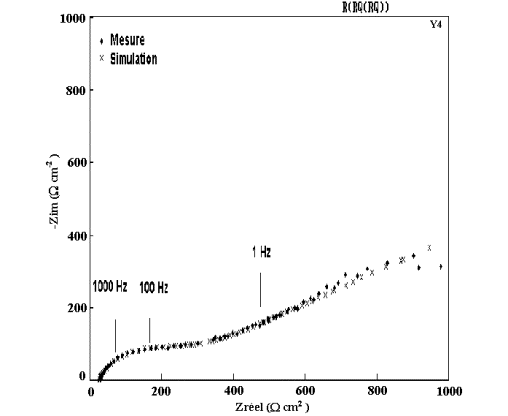
Figure 55: Modélisation et diagramme expérimental d'impédance
du dépôt B4 ( 13 % Mn) après 1 heure d'immersion dans NaCl 0,5M.
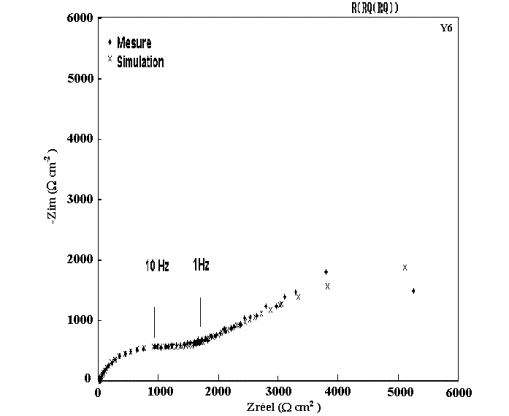
Figure 56: Modélisation et diagramme expérimental d'impédance
du dépôt B6 (15 % Mn) après 1 heure d'immersion dans NaCl 0,5M.
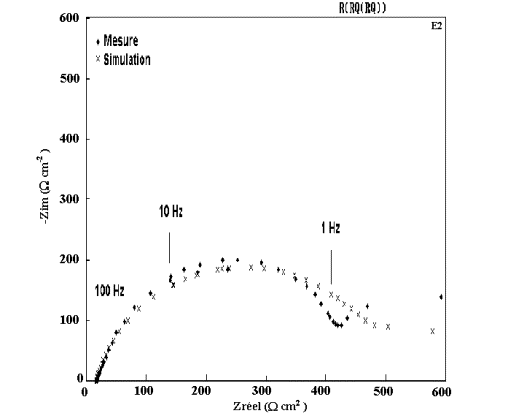
Figure 57: Modélisation et diagramme expérimental d'impédance
du dépôt A2 ( 0 % Mn) après 1 heure d'immersion dans NaCl 0,5M.
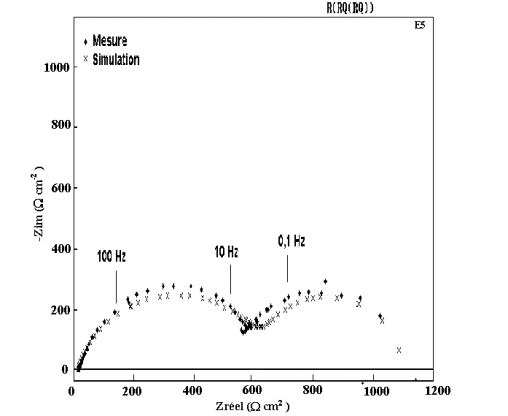
Figure 58: Modélisation et diagramme expérimental d'impédance
du dépôt A5 ( 0 % Mn) après 1 heure d'immersion dans NaCl 0,5M.
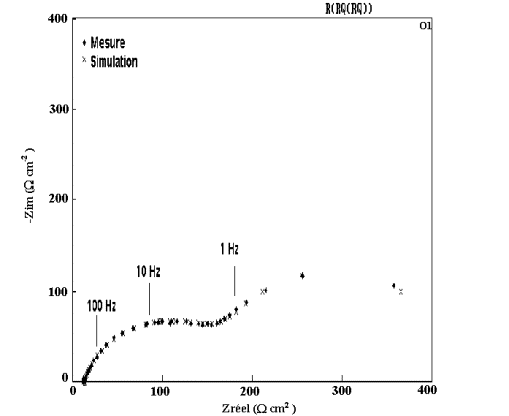
Figure 59: Modélisation et diagramme expérimental d'impédance
du dépôt O1 ( 0 % Mn) après 1 heure d'immersion dans NaCl 0,5M.